2. 上海污染控制与生态安全研究院, 上海 200092
2. Shanghai Institute of Pollution Control and Ecological Security, Shanghai 200092, China
除虫菊是一种多年生草本菊科植物, 其花朵中可提取出天然除虫菊酯并用以制成各种杀虫产品[1].天然除虫菊酯对温血动物毒性极低[2], 对昆虫击倒速度快[3], 在环境中及动物体内无残留, 已被广泛应用了100多年而没有出现抗性报道, 被认为是最为安全和有效的天然杀虫剂[4].然而除虫菊酯易被阳光、空气、较高的温度及金属离子分解, 这种不稳定性使天然除虫菊酯类产品在生产及储存过程中有效成分含量不断损失, 影响杀虫效力, 而且作用的持效性短, 导致施药成本增加[5].
目前天然除虫菊酯大多采取原药稀释制备成乳油、水乳剂等的乳液形式进而应用, 但除虫菊酯的环境不稳定性会导致持效性短、施药成本增加.也有研究报道将除虫菊酯制备成纳米微胶囊进行应用, 但所用壁材多为甲基丙烯酸甲酯和苯乙烯, 材料存在毒性或致癌性, 且工艺复杂、制备成本高[6-7].而关于天然除虫菊酯微胶囊的应用却鲜有研究报道.
微胶囊技术具有延长芯材存放时间, 防止被空气氧化, 掩盖芯材不良气味等功效[8].这种技术的优势在于形成微胶囊时, 芯材被包裹并与外界环境隔离, 而它的性质能被毫无影响地保留下来[9]; 并在适当的条件下, 如压力、pH值、酶、温度等可以完全释放出来[10-11].
β-环糊精(β-CD)是由7个吡喃型葡萄糖分子以α-1, 4-糖苷键连接而成的环状化合物, 其外形呈圆台状, 亲水性基团分布在表面形成亲水区, 而内部的中空部位则分布着疏水性基团形成疏水区, 疏水中心可与许多物质形成包接配合物并置于中心部位而完成包合过程.其分子结构及立体结构如图 1所示.

|
图 1 β-环糊精的分子结构及立体结构 Fig.1 Molecular structure and stereostructure of β-cyclodextrin |
敖慧君等[12]以β-环糊精为壁材对维生素E进行微胶囊化, 成功解决了维生素E易氧化、光热不稳定的问题.Ayala-Zavala等[13]利用β-环糊精制备了以肉桂精油和大蒜精油为芯材的抗菌剂微胶囊, 改善了肉桂精油和大蒜精油易挥发的特性, 为其更好地应用在食品工业中奠定基础.
本研究旨在使用经济、环保、无毒的β-环糊精为壁材, 制备天然除虫菊酯微胶囊, 并对微胶囊进行性能表征和应用研究.微胶囊化有助于延长天然除虫菊酯的持效期, 减少施药次数和频率, 从而提高农药的利用率, 对于微胶囊剂的制备和使用推广具有重要的意义.
1 材料与方法 1.1 试验材料与仪器本研究采用从国药集团化学试剂有限公司采购的β-环糊精作为微胶囊的壁材, 芯材为森菊发展肯尼亚有限公司提供的除虫菊酯原液, 本研究所用的其他化学试剂均为分析纯级.
实验仪器有:恒温磁力搅拌器(DF-101D, 巩义市予华仪器有限责任公司); 真空干燥箱(DZF-6020, 上海精宏试验设备有限公司); 超声细胞破碎仪(SY-300, 上海宁商超声仪器有限公司); 扫描电子显微镜(SEM, XL-30E, 荷兰Philips公司); 综合热分析仪(Q600 SDT, 美国TA公司); 傅里叶变换红外光谱仪(BRUKER VECTOR 22, 瑞士Bruker公司); 气相色谱-质谱仪(GCMS-QP 2010SE, 日本岛津公司); 马尔文激光粒度分析仪(Mastersizer 3000, 英国马尔文仪器有限公司)等.
1.2 微胶囊的制备与表征根据徐冉等[14]的方法制备以β-环糊精为壁材的天然除虫菊酯微胶囊.称取1 g的天然除虫菊酯原液溶解分散于5 mL乙醇中, 再称取9 g的β-环糊精倒入100 g水中, 70 ℃水浴搅拌, 待完全溶解后, 将已经完全分散的芯材溶液倒入β-环糊精溶液中, 并降低温度至55 ℃, 继续水浴搅拌包合4 h后, 包合形成的微胶囊慢慢以沉淀析出.调节温度至43 ℃继续保温固化16 h.反应结束后, 抽滤, 50 ℃烘箱干燥24 h, 得到包埋率(囊壁包裹的芯材占微胶囊总除虫菊酯含量的百分比)为92.15%、载药率(芯材占微胶囊总质量的百分比)为8.5%、粒径范围为1~17 μm的固体天然除虫菊酯微胶囊.粒径在1~40 μm之间, 符合农药微胶囊的应用要求[15].反应机理如图 2所示.图中, R、R′表示除虫菊酯分子结构中相连的不同烷基.

|
图 2 包合法制备天然除虫菊酯微胶囊机理图 Fig.2 Mechanism of preparation of natural pyrethrins microcapsule by inclusion method |
采用气相色谱法对天然除虫菊酯原药及所制备微胶囊进行定性定量分析.采用扫描电子显微镜(scanning electron microscope, SEM), 对样品在氮气保护下进行表面喷金后在3.0 kv的扫描电压下观察其表面形貌.采用傅里叶变换红外光谱仪(Fourier transform infrared, FTIR), 用KBr压片法对所制备的微胶囊进行官能团测定.
1.3 微胶囊的应用研究对所制备的微胶囊进行应用研究, 包括热稳定性分析、缓释性能测定、储存稳定性测定、作用时长分析及蚊虫的毒性实验研究.
利用综合热分析仪测定微胶囊的热稳定性, 取10~15 mg干燥微胶囊粉末于氧化铝坩埚内, 测量样品在N2氛围下, 10 ℃·min-1的升温速度时, 50~600 ℃温度范围内的质量损失百分比.
参照Fan等[16]、周明松等[17], 以透析袋法测定微胶囊的缓释性能.称取除虫菊酯原药或微胶囊粉末于盛有3 mL释放介质(乙腈和超纯水体积比为1:1的混合溶液)的透析袋中(截留分子量为7 000 g·mol-1), 将袋口密封后放入装有150 mL释放介质的烧杯中, 置于恒温摇床中以100 r·min-1振荡.每隔一定时间取1 mL烧杯中的释放介质, 测定其中天然除虫菊酯浓度, 再补充1 mL释放介质; 则可计算并绘制出天然除虫菊酯累积释放量-时间的缓释曲线.
将制备好的微胶囊粉末装入密封袋中, 避光储存在4 ℃冰箱, 隔一段时间后, 通过扫描电镜观察其形貌的变化, 通过测定载药率得出其芯材的损失量, 从而判断微胶囊的储存稳定性.
测试以β-环糊精为壁材的微胶囊分别对淡色库蚊和白纹伊蚊幼虫、二化螟幼虫、粘虫(3龄初期幼虫)的毒力(试虫均取自于上海南方农药研究中心), 24 h后记录试虫的死亡数, 实验重复2次, 并进行统计分析.
2 结果与讨论 2.1 气相色谱分析采用气相色谱法, 用乙醇洗去微胶囊表面未被包埋的除虫菊酯后, 在200 Hz的超声细胞破碎仪中超声5 min破囊, 而后将样品进行气相色谱测定和定性定量的分析.色谱图中可观察到如图 3所示除虫菊酯的6个特征峰, 说明微胶囊制备成功, 天然除虫菊酯存在于微胶囊的内部空腔结构.
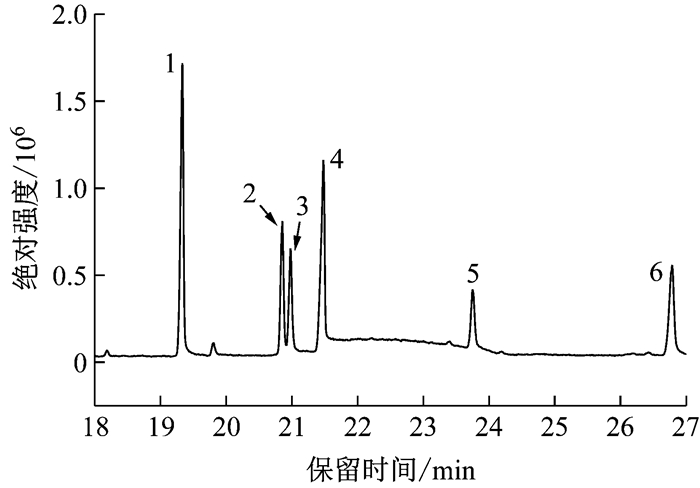
|
1-除虫菊素Ⅰ 2-瓜叶菊素Ⅰ 3-茉酮菊素Ⅰ 4-瓜叶菊素Ⅱ 5-茉酮菊素Ⅱ 6-除虫菊素Ⅱ 图 3 气相色谱图 Fig.3 Gas chromatogram |
所制备的微胶囊包埋率为92.15%, 载药率为8.5%, 其中未被壁材包埋、附着在微胶囊表面的芯材, 虽然不能起到缓慢释放的作用, 但可以作为即时药效, 和被包埋的芯材共同结合起到瞬时及缓释二合一的作用.理论载药率为10%, 而实际制备的微胶囊载药率为8.5%, 未结合在固体微胶囊中, 即仍在乳液中的除虫菊酯可以作为瞬时药效直接喷洒应用.
2.2 SEM分析图 4为以β-环糊精为壁材的天然除虫菊酯微胶囊的扫描电镜图, 其中图 4a、4b的放大倍数分别为2 000倍和7 000倍.通过SEM图可以看出, 微胶囊保留了β-环糊精的近似菱形结构, 天然除虫菊酯进入β-环糊精的疏水空腔部分形成微胶囊.虽然微胶囊的表面形貌没有太大变化, 但根据气相色谱和红外光谱等的定性分析, 均可得出除虫菊酯已被成功包埋.说明除虫菊酯与β-环糊精的疏水性结构相结合并存在于其内部的空腔结构中, 因而未对壁材的表面形貌产生影响.

|
图 4 β-环糊精微胶囊扫描电镜图 Fig.4 SEM of β-CD microcapsule |
图 5为以β-环糊精为壁材的微胶囊的红外光谱图, 其中1、2和3图线分别代表天然除虫菊酯原药、空白微胶囊和天然除虫菊酯微胶囊的红外谱图.对比图线1和2可见, 图线1在1 717 cm-1处的吸收峰是酯类C=O伸缩振动的特征峰, 来自天然除虫菊酯的酯基官能团; 图线2在1 257 cm-1和1 376 cm-1处的中等强度的峰为O-H的弯曲振动, 3 332 cm-1处有一个宽且较强的峰, 为-OH的伸缩振动吸收峰.对比图线2和3可见, 图线3在1 719 cm-1处出现了新的天然除虫菊酯的特征峰, 且在2 923cm-1处的吸收峰出现增强, 也说明是除虫菊酯和β-环糊精的叠加, 证明了天然除虫菊酯成功进入β-环糊精的疏水空腔.
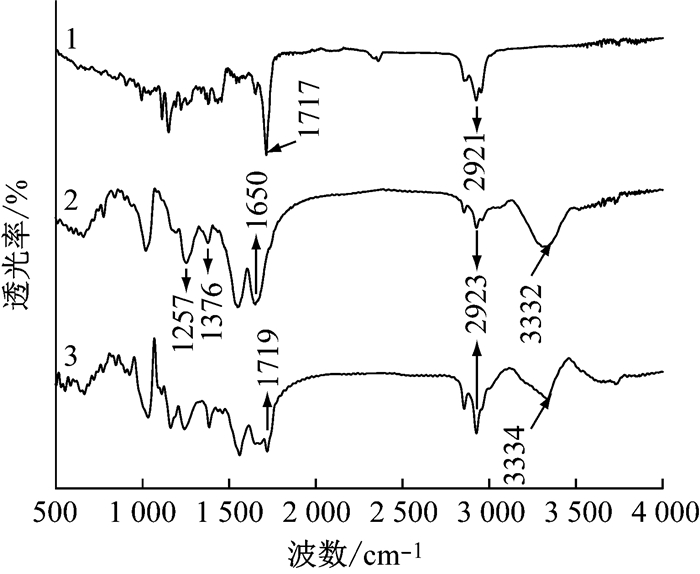
|
1-天然除虫菊酯 2-空白微胶囊 3-天然除虫菊酯微胶囊 图 5 红外光谱图 Fig.5 FTIR |
图 6为以β-环糊精为壁材的微胶囊热重分析曲线.其中图 6a为样品随着温度升高的热分解过程, 即热重分析(thermal gravity analysis, TG)曲线.图 6b为TG曲线对温度的一阶导数, 以样品的质量变化速率对温度作图, 即DTG(differential thermal gravity)曲线.曲线1、2和3分别是天然除虫菊酯、空白微胶囊和除虫菊酯微胶囊的曲线.
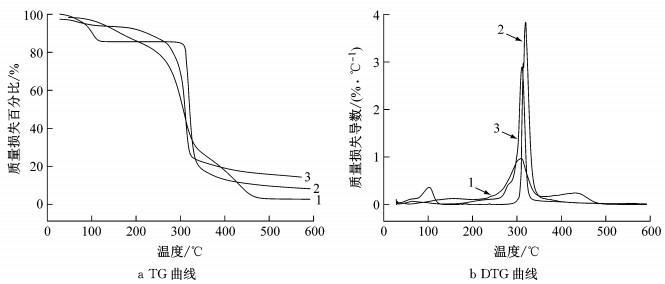
|
1-天然除虫菊酯 2-空白微胶囊 3-天然除虫菊酯微胶囊 图 6 微胶囊的热重分析曲线 Fig.6 Thermogravimetric analysis of microcapsule |
从图中可看出天然除虫菊酯共有三个阶段的质量损失: 130℃之前出现的2%~15%的质量损失是由样品中少量残余的水分挥发引起的, 天然除虫菊酯在130℃~200℃之间出现第一次明显的质量损失, 损失约为15%, 说明天然除虫菊酯原药开始分解; 第二个较为急速的质量损失出现在250℃~350℃范围内, 损失量约为50%, 说明天然除虫菊酯的热解主要集中在此温度范围内; 最后在350℃~480℃范围内, 曲线1出现了第三阶段天然除虫菊酯的质量损失, 此时热解完全, 原药几乎无剩余.
而从图线2和3中可看出, 130℃~200℃之间微胶囊几乎无质量损失, 这是由于β-环糊精在此温度范围内热稳定性显著, 保护了内部的天然除虫菊酯活性成分, 阻止或减缓其损失.在280℃时除虫菊酯微胶囊存在明显的质量损失, 且相对图线2, 其分解温度减小, 曲线前移, 说明除虫菊酯的存在使β-环糊精结构发生了微小变化.这一结果也与Prabu等[18]对咖啡因包合物与β-环糊精包合物及其各自的纯化合物的分解温度的研究结果相似.也有研究表明[19], 主、客体间的疏水相互作用在包合物的热稳定性方面起重要的作用.同时, 曲线3相对于曲线1后移, 热分解温度向高温度移动.说明微胶囊相对于原药可以耐受更高的温度而不发生较大的质量损失.以上说明, 以β-环糊精为壁材制备的除虫菊酯微胶囊相比于天然除虫菊酯具有更好的热稳定性.
2.5 缓释性能分析图 7为天然除虫菊酯原药和以β-环糊精为壁材的微胶囊的缓释曲线.从图中可以看出, 天然除虫菊酯原药在20 h累计释放率达到85%, 并在此之后累计释放率增速极其缓慢, 在34 h, 累计释放率达到99.6%, 释放将近完全.而以β-环糊精为壁材的天然除虫菊酯微胶囊在20 h的累计释放率为55%, 在34 h累计释放率达到71.5%, 此后累计释放率增速减缓, 直至70 h, 累计释放率达到89.3%.
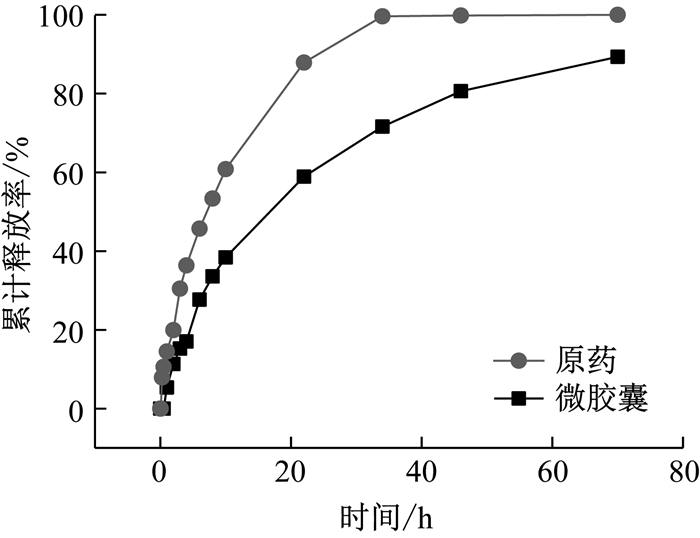
|
图 7 微胶囊的缓释曲线 Fig.7 Slow-release curve of microcapsule |
为了进一步考察微胶囊的释放动力学, 将微胶囊的缓释数据分别代入常见的4种释放动力学模型进行参数拟合:零级动力学模型、一级动力学模型、Higuchi模型、Ritger-peppas模型, 4种释放动力学模型的拟合公式及其对应相关系数R2见表 1.表中t为时间, h; Q为t时所对应的累计释放率.
| 下载CSV 表 1 动力学模型拟合结果 Tab.1 Fitting results of dynamic model |
对4种不同动力学模型的拟合结果比较可知, 以β-环糊精为壁材的天然除虫菊酯微胶囊的缓释机制最符合一级动力学模型, 其扩散行为与时间t存在指数相关关系.该模型拟合下微胶囊释放方程为Q = 88.05 (1-e -0.055 t ), 相关系数R2=0.995 5.而闫丹丹[20]制备的丁香精油/β-环糊精微胶囊缓释结果也接近一级拟合模型, 结果相似.微胶囊累计释放率的一级动力学模型拟合曲线如图 8所示.

|
图 8 微胶囊累计释放率的一级动力学模型拟合曲线 Fig.8 Fitting curve of first-order kinetic model for cumulative release rate of microcapsule |
从图 8中可以看出, 微胶囊芯材的释放行为可以分为两个阶段, 在2~30 h时, 微胶囊内外浓度差较大, 囊内活性成分释放速率较快, 30 h后, 随着微胶囊囊内活性成分的减少, 扩散驱动力减小, 释放速率减缓, 最终缓慢释放完全.
以上说明, 以β-环糊精为壁材的天然除虫菊酯微胶囊具有良好的缓释性能, 且相对原药缓慢释放效果更佳, 持效性长, 其缓释行为符合一级动力学模型.
2.6 储存稳定性分析图 9是在4℃冰箱中保存一段时间后, 微胶囊的扫描电镜图.图 9a、9b和9c分别是储存0、5、9个月后的SEM图, 对比图 9a、9b可见微胶囊表面没有发生太大的变化; 图c中的微胶囊表面有破裂现象, 此为储存时间太长导致壁材的机械性能变差, 从而发生破裂.

|
图 9 微胶囊储存稳定性扫描电镜图 Fig.9 SEM of storage stability of microcapsule |
通过测定不同储存时间下微胶囊的载药率, 可计算出芯材随着储存时间的残留率.如图 10可见5个月后, 微胶囊的残留载药率为87.2%, 9个月后芯材损失了约50%.可见以β-环糊精为壁材的微胶囊具有较好的储存稳定, 而为了更好地提高微胶囊的作用效果和持效性, 建议储存时间为5个月内的微胶囊可以继续使用, 而更长储存时间的微胶囊在使用过程中需要提高剂量以达到同样的杀虫效果.

|
图 10 微胶囊的储存稳定性 Fig.10 Storage stability of microcapsule |
图 11是将含有相同除虫菊酯浓度的微胶囊悬浮剂和原药水乳剂放置于自然条件下, 进而模拟在使用过程中两者作用时长的对比图.从图中可看出, 在使用过程中, 原药水乳剂的残留率在6 d后即下降为12%, 而10 d后完全分解; 微胶囊悬浮剂在6 d后载药残留率为40%, 在15 d时仍有15%的载药率.邵凡旭等[21]研究发现25%除虫菊素69 g·ha-1(6.9×10-3g·m-2)对棕榈蓟马药后3 d的防效接近或超过60%, 但持效期较短, 药后7 d防效大幅下降; 而5%除虫菊素乳油800, 1000倍液喷雾防治孔雀竹芋红蜘蛛和桃树红蜘蛛的持效期也在7 d左右[22-23].
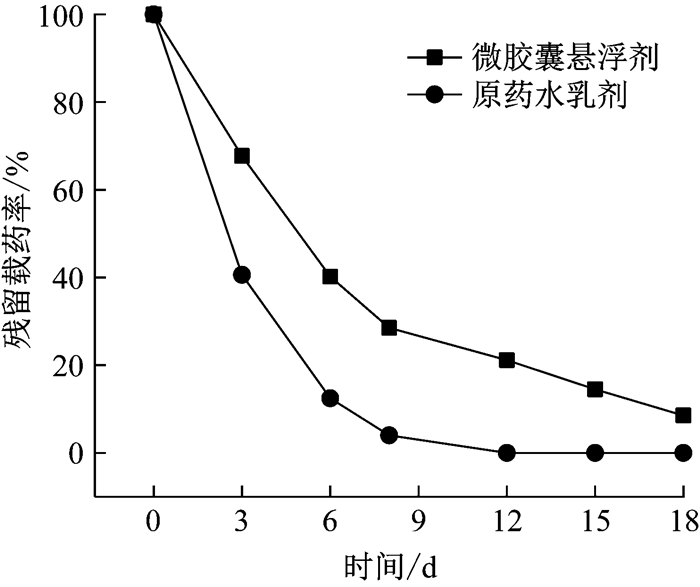
|
图 11 作用时长对比图 Fig.11 Contrast of the duration of efficacy |
从作用时长对比图分析可知, 微胶囊相比原药制剂可以延长1~1.5倍的作用时间, 降低了使用频率, 可达到减少约45%使用成本的效果, 具有实际应用价值.
2.8 杀虫活性分析以β-环糊精为壁材的天然除虫菊酯微胶囊对淡色库蚊和白纹伊蚊幼虫的生物毒性测定结果如表 2所示, 其中LC50为杀死50%防治对象的药剂质量浓度, LC90为杀死90%防治对象的药剂质量浓度, mg·L-1.从表中可看出, 所制微胶囊对于蚊子具有很好的防治效果.
| 下载CSV 表 2 淡色库蚊幼虫和白纹伊蚊幼虫的毒性测定结果 Tab.2 Toxicity of Culex pipiens pallens larvae and Aedes albopictus larvae |
采用生物统计软件计算出微胶囊对二化螟、蚜虫和粘虫的LC50等统计数据, 得出结果如表 3所示, 其中括号内数字表示致死浓度的波动范围.此三种害虫的LC50、LC90基本上小于50 mg·L-1, 可见微胶囊对此三种害虫具有较高的杀虫活性, 可以在防治二化螟、蚕豆蚜和粘虫时单独使用, 由于其作用快速, 适宜在卵孵高峰期施药, 等幼虫开始危害时正好发挥药效.
| 下载CSV 表 3 施药24 h后三种害虫的毒力基线统计 Tab.3 Toxicity baselines statistics of three pests after treatment for 24 hours |
本研究采用包合法制备了以β-环糊精为壁材的天然除虫菊酯微胶囊, 包埋率为92.15%, 载药率为8.5%, 粒径范围为1~17 μm.热重法分析表明微胶囊阻止或减缓了天然除虫菊酯在130℃时的第一阶段的热分解, 且出现急速质量损失的热分解温度向更高方向移动, 相对于原药可以耐受更高的温度, 具有较好的热稳定性.透析袋缓释实验表明天然除虫菊酯微胶囊相对原药缓慢释放效果更佳, 持效性长, 具有良好的缓释性能且其缓释行为符合一级动力学模型.在4℃冰箱内避光保存5个月后, 微胶囊的形态仍然完整, 载药率降低了约13%, 说明微胶囊具有良好的储存稳定性.自然条件下, 微胶囊相比原药制剂可以延长1~1.5倍的作用时间, 降低了使用频率, 可以减少约45%的使用成本, 具有实际应用价值.
微胶囊对淡色库蚊幼虫和白纹伊蚊幼虫的LC50分别为0.77×10-6和1.81×10-6 mg·L-1, LC90分别为2.63×10-6和3.73×10-6 mg·L-1, 在灭蚊方面表现出较高的活性.采用生物统计软件计算出二化螟、蚜虫和粘虫的LC50、LC90基本上小于50 mg·L-1, 可见微胶囊对此三种害虫具有较高的杀虫活性, 可以在防治二化螟、蚕豆蚜和粘虫时单独使用, 由于其作用快速, 适宜在卵孵高峰期施药, 等幼虫开始危害时正好发挥药效.
| [1] |
王丰玲, 张英锋, 李阳, 等. 绿色杀虫剂-天然除虫菊酯[J]. 渤海大学学报(自然科学版), 2008, 29(2): 21 WANG Fengling, ZHANG Yingfeng, LI Yang, et al. Natural pyrethrum ester: green pesticide[J]. Journal of Bohai University (Natural Science Edition), 2008, 29(2): 21 |
| [2] |
ELLIOTT M. Synthetic pyrethroids[C]// ACS Symposium Series. Washington D C: American Chemical Society, 1977: 1-28.
|
| [3] |
张夏亭, 聂秋林, 高欣. 除虫菊素的杀虫特性与作用机理[J]. 农药科学与管理, 2003, 24(2): 22 ZHANG Xiating, NIE Qiulin, GAO Xin. The characteristic and mechanism of pyrethrins acting in pests[J]. Pesticide Science and Management, 2003, 24(2): 22 DOI:10.3969/j.issn.1002-5480.2003.02.010 |
| [4] |
朱丽华. 天然植物源杀虫剂——除虫菊[J]. 世界农药, 2002, 24(3): 30 ZHU Lihua. Pyrethrum, a natural botanical insecticide[J]. World Pesticides, 2002, 24(3): 30 DOI:10.3969/j.issn.1009-6485.2002.03.008 |
| [5] |
ELLIOTT M, JANES N F. Chemistry of the natural pyrethrins[J]. Fortschr Chem Org Naturst, 1973, 19(19): 120 |
| [6] |
武锦, 周艺峰, 陈静, 等. 微乳液聚合法制备天然除虫菊酯纳米胶囊[J]. 高分子材料科学与工程, 2008, 24(2): 35 WU Jin, ZHOU Yifeng, CHEN Jing, et al. Preparation of natural pyrethrum nanocapsule by means of microemulsion polymerization[J]. Polymer Materials Science and Engineering, 2008, 24(2): 35 DOI:10.3321/j.issn:1000-7555.2008.02.009 |
| [7] |
武锦, 陈静, 周艺峰, 等. 天然除虫菊素和阿维菌素纳米胶囊结构表征及杀虫活性测定[J]. 农药, 2007, 46(10): 672 WU Jin, CHEN Jing, ZHOU Yifeng, et al. Structure characterization and insecticidal activity tests of natural pyrethrin and abermectin nanocapsules[J]. Agrochemicals, 2007, 46(10): 672 DOI:10.3969/j.issn.1006-0413.2007.10.008 |
| [8] |
PIACENTINI E, GIORNO L, DRAGOSAVAC M M, et al. Microencapsulation of oil droplets using cold water fish gelatine/gum arabic complex coacervation by membrane emulsification[J]. Food Research International, 2013, 53(1): 362 DOI:10.1016/j.foodres.2013.04.012 |
| [9] |
郭雯婷, 崔蕊蕊, 庄占兴, 等. 农药微胶囊剂的研究现状与展望[J]. 现代农药, 2017, 16(2): 1 GUO Wenting, CUI Ruirui, ZHUANG Zhanxing, et al. Research situation and prospect of pesticide microcapsule[J]. Modern Agrochemicals, 2017, 16(2): 1 DOI:10.3969/j.issn.1671-5284.2017.02.001 |
| [10] |
SHEKHAR K. A review on microencapsulation[J]. Int. J. Pharm. Sci. Rev. Res, 2010, 5(2): 58 |
| [11] |
BANSODE S. Microencapsulation: a review[J]. International Journal of Pharmaceutical Sciences Review and Research, 2010, 1(2): 38 |
| [12] |
敖慧君, 黄清松. 维生素E微胶囊的制备工艺研究[J]. 赣南医学院学报, 2015, 35(1): 33 AO Huijun, HUANG Qingsong. Study on the preparation of vitamin E microcapsules[J]. Journal of Gannan Medical University, 2015, 35(1): 33 DOI:10.3969/j.issn.1001-5779.2015.01.0010 |
| [13] |
AYALA-ZAVALA J F, SOTO-VALDEZ H, GONZÁLEZ-LEÓN A, et al. Microencapsulation of cinnamon leaf (cinnamomum zeylanicum) and garlic (allium sativum) oils in β-cyclodextrin[J]. Journal of Inclusion Phenomena and Macrocyclic Chemistry, 2008, 60(3/4): 359 |
| [14] |
徐冉, 李风亭, 袁建梅, 等.以β-环糊精或其衍生物为壁材的除虫菊酯微胶囊剂及其制备方法和应用: 中国, CN108184833A[P]. 2018-06-22. XU Ran, LI Fengting, YUAN Jianmei, et al. Preparation of pyrethrins microcapsules by β-cyclodextrin or its derivatives and applications: China, CN108184833A[P]. 2018-06-22. |
| [15] |
陆静.高效氯氟氰菊酯微胶囊悬浮剂的研制及释放机理研究[D].杭州: 浙江工业大学, 2013. LU Jing. Study on preparation and release mechanism of high-performance cyhalothrin microcapsule suspension[D]. Hangzhou: Zhejiang University of Technology, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10337-1014150713.htm |
| [16] |
FAN T, FENG J, MA C, et al. Preparation and characterization of porous microspheres and applications in controlled-release of abamectin in water and soil[J]. Journal of Porous Materials, 2014, 21(1): 113 DOI:10.1007/s10934-013-9754-7 |
| [17] |
周明松, 刘庆芳, 王素雅, 等. 静电自组装法制备阿维菌素微胶囊[J]. 精细化工, 2017, 34(5): 519 ZHOU Mingsong, LIU Qingfang, WANG Suya, et al. Preparation of avermectin microcapsules by electrostatic self-assembly method[J]. Fine Chemicals, 2017, 34(5): 519 |
| [18] |
PRABU S, SWAMINATHAN M, SIVAKUMAR K, et al. Preparation, characterization and molecular modeling studies of the inclusion complex of Caffeine with Beta-cyclodextrin[J]. Journal of Molecular Structure, 1984, 100(2): 303 |
| [19] |
WANG Qifang, FAN Xiaowen, WANG Zhongyan, et al. Study on thermal decomposition kinetics for inclusion complexes of drug with β-cyclodextrin and β-cyclodextrin polymer[J]. Chinese Journal of Pharmaceutics, 2007, 5: 9 |
| [20] |
闫丹丹.基于微胶囊技术的淀粉基抗菌膜制备及性能研究[D].无锡: 江南大学, 2016. YAN Dandan. Study on the preparation and property of starch-based antibacterial film by microcapsules technology[D]. Wuxi: Jiangnan University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10295-1016273759.htm |
| [21] |
邵凡旭, 杨栋, 任立云. 14种生物杀虫剂对棕榈蓟马的田间防治效果[J]. 南方农业学报, 2015, 46(7): 1237 SHAO Fanxu, YANG Dong, REN Liyun. Field experiment on control effects of 14 biopesticides on thrips palmi karny[J]. Journal of Southern Agriculture, 2015, 46(7): 1237 DOI:10.3969/j:issn.2095-1191.2015.7.1237 |
| [22] |
李绍萍, 赵明方, 陈武荣, 等. 5%除虫菊素乳油对孔雀竹芋红蜘蛛的防效[J]. 北方园艺, 2012(4): 134 LI Shaoping, ZHAO Mingfang, CHEN Wurong, et al. Efficacy of 5% pyrethrin on tetranychus cinnbarinus of calathea makoyana[J]. Northern Horticulture, 2012(4): 134 |
| [23] |
王向阳, 李昌春, 刘伟, 等. 5%除虫菊素乳油防治桃树红蜘蛛田间药效试验[J]. 安徽农学通报, 2010, 16(3): 106 WANG Xiangyang, LI Changchun, LIU Wei, et al. Efficacy of 5% pyrethrin on peach red spider[J]. Anhui Agricultural Science Bulletin, 2010, 16(3): 106 DOI:10.3969/j.issn.1007-7731.2010.03.051 |
 2019, Vol. 47
2019, Vol. 47
